(6分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
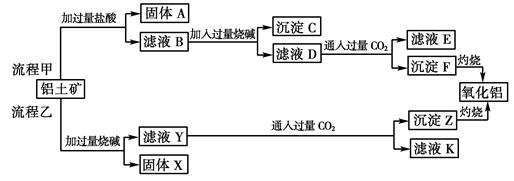
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32—的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中溶质的主要成份是 (填化学式),写出该溶液的一种用途
。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)= 。
(6分,每空1分):(1)Al2O3+6H+===2Al3++3H2O
(2)SiO2+2OH-===SiO32—+H2O (3)硫氰化钾(或硫氰酸、苯酚溶液等合理答案)
(4)NaHCO3 制纯碱或做发酵粉等合理答案 (5)5.6×10-10 mol/L
(1)氧化铝是两性氧化物,和盐酸反应的方程式是Al2O3+6H+===2Al3++3H2O。
(2)二氧化硅是酸性氧化物,和氢氧化钠溶液反应的方程式是SiO2+2OH-===SiO+H2O。
(3)检验铁离子的试剂是KSCN溶液或者是苯酚。
(4)由于CO2都是过量的,所以溶液中的溶质主要都是碳酸氢钠,其主要用途是制纯碱或做发酵粉等。
(5)pH=13,所以溶液中的OH-浓度是0.1mol/L,因此根据氢氧化镁的溶度积常数可知,此温度下残留在溶液中的c(Mg2+)=5.6×10-12÷0.12=5.6×10-10 mol/L。
