某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
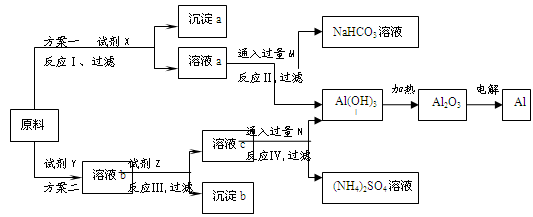
(1)试剂X的化学式为 ,反应Ⅰ的离子方程式是 。实验室配制480mL 1 mol·L-1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有 。常用来可以标定所配X的溶液浓度是否准确的实验名称是 。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3]。从试剂工业的角度,你认为方案 更合理,理由是 。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。
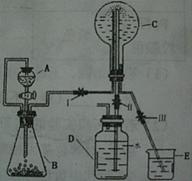
①仪器A的名称是 ,装置中A口部和B口部之间联通导气管的作用是 。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的 (填字母序号)。
a.生石灰 b.烧碱 c.胆矾 d.碱石灰
(4)室温下,在a mol·L-1的(NH4)2SO4水溶液中pH=5,存在着平衡NH4++H2O  NH3·H2O+H+,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH3·H2O+H+,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
(1)NaOH(1分),Al2O3+2OH-+3H2O=2[Al(OH)4]-(2分),500mL容量瓶(2分,不写500mL只得1分),滴定或中和滴定(1分);
(2)方案一(1分),步骤少,较简单(2分);
(3)①长颈漏斗(1分),平衡内外压强,防止长颈漏斗堵塞(2分);
(4)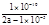 (2分)。
(2分)。
题目分析:
(1)流程图中的原料为:氧化铝(杂质为Fe2O3),方案I中为先加入强碱溶液过滤后再向溶液中通入二氧化碳气体,即得到氢氧化铝再进行后续步骤;故此试剂X一般选用NaOH;反应I为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;配制480mL 1 mol·L-1氢氧化钠溶液时,应选取500mL容量瓶且必须标明容量瓶的容积;确定配制溶液的浓度是否准确,应进行滴定或中和滴定实验;
(2)方案二中,首先加入硫酸溶解氧化铁和氧化铝,再在步骤二中加入试剂调整pH值析出氢氧化铁沉淀,过滤后再向硫酸铝溶液中通入氨气,制取氢氧化铝;分析两方案,很明显方案一步骤少,较简单,是较佳方案;
(3)根据装置图,制取氨气并完成喷泉实验时,仪器A为长颈漏斗;A口部和B口部之间联通导气管的作用是平衡内外压强,防止长颈漏斗堵塞;
(4)a mol·L-1的(NH4)2SO4水溶液中pH=5,则溶液中的c(H+)=10-9mol·L-1,故c(NH3·H2O)=c(OH-)=10-5mol·L-1,c(NH4+)=2a-10-5mol·L-1,根据水解的离子方程式:NH4++H2O  NH3·H2O+H+,可得k=
NH3·H2O+H+,可得k=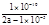 。
。
