一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g) 4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
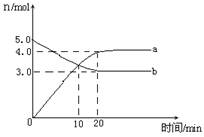
A.10min时,反应达到平衡
B.达到平衡时N2O5的转化率为60%
C.0~20min内平均反应速率v(N2O5)=0.05mol∙L-1∙min-1
D.曲线a表示NO2的物质的量随反应时间的变化
CD
题目分析:读图可知,20min时反应达到平衡,10min时反应没有达到平衡,仍向正反应方向进行,故A错误;读图可知,曲线b是表示反应物的物质的量随反应时间变化的示意图,且△n(N2O5)=(5.0—3.0)mol=2.0mol,则平衡时N2O5的转化率=2.0/5.0×100%=40%,故B错误;由于v=△c/△t=△n /(V•△t) =2.0mol÷2L÷20min=0.05mol/(L•min),故C正确;曲线a是表示生成物的物质的量随反应时间变化的示意图,该反应有两种生成物,由于变化物质的量之比等于化学方程式中系数之比,即(5.0—3.0)mol/(4.0—0)mol=2/4,由于曲线b表示N2O5的物质的量随反应时间的变化,则曲线a表示NO2的物质的量随反应时间的变化,故D正确。
