下图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图。开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B。以下结论正确的是
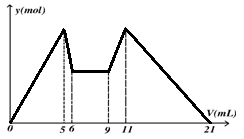
A.A可能是NaOH,B可能是盐酸,且2 c(A)=c(B)
B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶2∶7
C.A可能是Ba(OH)2,B可能是硫酸,且c(A)=2c(B)
D.若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B
答案:D
题目分析:A选项,根据加入量与沉淀溶解关系图可知,先加入的a为NaOH,之后加入的b为酸,并根据5-6ml沉淀溶解应为Al(OH)3+OH-=AlO2-+2H2O,物质的量之比为1:1;9-11ml生成沉淀为AlO2-+H++H2O=Al(OH)3,物质的量之比为1:1。故二者的浓度比 c(A)=2c(B)。故A错误。B选项,从加入5 mL A生成沉淀最多,再继续加1 mL A沉淀量减少到最小值,相应反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,由此可知,n(Al3+)=n〔Al(OH)3〕=(1×6×10-3)mol;由前5 mL NaOH形成最大沉淀量可知,2n(Mg2+)+3n(Al3+)=(5×10-3×6)mol,所以n(Mg2+)=(1×6×10-3) mol;溶液中阴阳离子所带电荷相等得,n(Cl-)=(5×10-3×6)mol,即溶液中c(Mg2+):c(Al3+):c(Cl-)=1:1:5,故B错误。C选项,若a为Ba(OH)2 ,b为硫酸,则6-9ml阶段应该有沉淀量的变化,但题中无变化,故C错误。D选项正确。若A和B均为一元强酸或一元强碱,根据二者的浓度比 c(A)=2c(B),故D正确。
