有三种质量比可能相同或不同的镁铝合金样品①、②、③。小明、小青、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究。
(1)小明取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,发生的反应为 [Al(OH)4]― + CO2+ H2O ═ Al(OH)3↓ + HCO3― 将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为 。
(2)小青取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则m2的取值范围是 。(2分)
(3)小红取不同质量的样品③分别和30mL同浓度的盐酸反应,所取合金质量与产生气体体积(标准状况下测定)如下表所示:
| 实验序号 | a | b | c |
| 合金质量(mg) | 510 | 765 | 918 |
| 气体体积(mL) | 560 | 672 | 672 |
(ⅱ)合金中镁的质量分数;
(ⅲ)在c组实验后,还需向容器中加入1.0mol/L的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
(1)47.06% (2)27V/33.6<m<24V/22.4(3)(ⅰ)2.0mol/L(ⅱ)47.06% (ⅲ)78mL
题目分析:(1)m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,发生的反应为 [Al(OH)4]― + CO2+ H2O ═ Al(OH)3↓ + HCO3― 将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g,该固体为氧化铝,所以镁的质量与该氧化铝中的氧元素的质量相等,故合金中镁的质量分数=16×3/(27×2+16×3)×100%=47.06%
(2)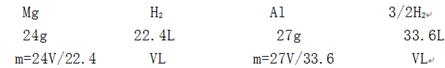
则 27V/33.6<m<24V/22.4
(3)(ⅰ)丙中盐酸反应完全,n(H2)="0.672L/22.4" L•mol -1=0.03mol
则c(HCl)=0.03mol×2/0.03L=2.0mol/L
(ⅱ)设合金中Mg、Al的物质的量分别为xmol,ymol, 则有:
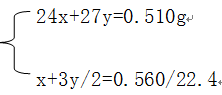
求得 x=y=0.01mol
则ω(Mg)=[(0.01mol×24g·mol-1)/0.510g]×100%="47.06%"
(ⅲ) 根据HCl ∽ NaCl和Al ∽ Na[Al(OH)4] 可知
n(NaCl)="n(HCl)=" 2.0mol/L×0.030L=0.06mol
n(Na[Al(OH)4] )="n(Al)=" 0.01mol×918/510=0.018mol
根据Na+ 守恒得:n(NaOH)= 0.06mol+0.018mol=0.078mol
所以V(NaOH)=" 0.078mol/1.0" mol•L-1=0.078L=78mL
点评:本题考查了镁铝及其化合物的相关计算,该计算题有一定的技巧性,本题综合性强,难度较大。
