有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种。现做如下实验:
一、取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成。
二、另取部分溶液,加入氢氧化钠,有白色沉淀产生,加入氢氧化钠的量与生成白色沉淀的量可用下图表示。
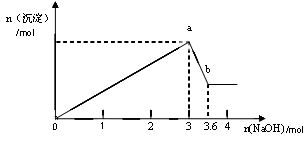
试推断:
(1)该溶液中一定存在__________ ____,一定不存在________________。
(2)由图可知白色沉淀共有__________种,分别是__________________(填化学式),其物质的量比为 。
(3) 写出图中a b变化过程的离子方程式 。
b变化过程的离子方程式 。
(1)Al3+、Mg2+、Cl- ; Fe3+、CO32-
(2)2; Al(OH)3、Mg(OH)2 ; 1:1
(3)Al(OH)3+ OH- AlO2-+ 2H2O
AlO2-+ 2H2O
题目分析:由于溶液是无色透明的,所以,首先排除Fe3+的存在,因为Fe3+的溶液呈棕黄色。取少量该溶液,滴入用硝酸酸化的AgNO 3溶液,有白色沉淀生成,说明该溶液中一定存在Cl-,因为只有AgCl白色溶液是不溶于稀HNO3的。另取部分溶液,加入氢氧化钠溶液,现象为先有沉淀,后沉淀消失,说明原溶液中一定存在Al3+、Mg2+,同时排除了CO32-的存在,因为Al3+、Mg2+与CO32--会反应,不能大量共存。而Na+与NO3-存不存在都对整个现象无影响。当沉淀的量达到最高时,再加入氢氧化钠溶液,沉淀部分消失,其原因是生成的氢氧化铝沉淀是两性氢氧化物,能与氢氧化钠溶液继续反应生成偏铝酸钠和水,而氢氧化镁沉淀则不能与氢氧化钠溶液反应。
