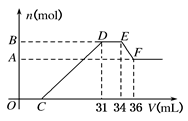
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是
A.无法求出曲线C点数值
B.合金与硝酸反应时硝酸过量
C.合金中铝的物质的量为0.008 mol
D.合金中金属的物质的量共为0.032 mol
答案:A
题目分析:反应始终没有气体生成,可以得出不会有氮的氧化物生成。又因为硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价。由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,所以硝酸的还原产物为硝酸铵。根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量为:(36-34)×10-3L×4mol/L=0.008 mol;根据NH4++OH-═NH3•H2O 得出n(NH4+)=(34-31)×10-3L×4mol/L=0.012 mol。根据氧化还原反应,N元素由+5价变为-3价,而金属都由0价变为+3价,可以运用电子守恒得出金属的物质的量为(0.012mol×8)÷3=0.032mol;滴加NaOH体积为31ml时,发生反应为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,可计算得出C点氢氧化钠溶液的体积为0.031L-(0.032mol×3)÷4mol/L=0.007L=7ml,所以选项A不正确,其余选项都是正确的,答案选A。
点评:该题是中等难度的试题,试题综合性强,贴近高考。该题以金属和硝酸的反应为载体,重点考查离子方程式的书写、氧化还原反应、化学计算、图像分析等知识点,试题针对性强,注重答题的灵活性,有利于培养学生的逻辑推理能力和创新思维能力。解答此题关键是明确反应的原理、判断出硝酸的还原产物以及得失电子转移守恒的运用等。
