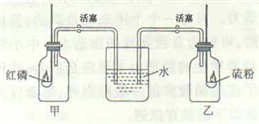
甲、乙两个等体积的集气瓶中充满了压强为101.3kPa的空气.两瓶各配置一个橡皮塞,两个橡皮塞中各插入一个燃烧匙和一根U形玻璃管,玻璃管的尾端插在水(含紫色石蕊)中(见图).在两个燃烧匙中分别加入过量的红磷和硫粉.先关闭活塞,使两个集气瓶处于密闭状态.再点燃燃烧匙中的红磷和硫粉(注:点燃装置未在图中画出).待燃烧结束后,冷却至室温.再同时打开两边的活塞,你推测可看到什么现象?并解释之.
①因过量的红磷燃烧时将甲瓶内的氧气耗尽,而生成物(P2O5)常温下为固体,4P+5O22P2O5(s).因此燃烧后甲瓶内呈负压状态,打开活塞后导致倒吸.因氧气约占空气的,故吸入水的体积约占甲瓶体积的.又因P2O5遇水生成酸,故石蕊变成红色.故答案:烧杯中的水迅速地被吸入甲集气瓶,吸入甲瓶的水变成红色,其体积约为集气瓶体积的.
②刚打开乙瓶活塞时未见任何变化,但等待一段时间后,发现玻管中水位逐渐升高,水慢慢地进入乙瓶并变成红色.当变化停止时,进入乙瓶的水的体积同样约是瓶体积的.虽然过量硫的燃烧同样耗尽了乙瓶中的氧气,但该反应是一个气体分子数不变的反应:S+O2 SO2生成的二氧化硫是气体.根据阿伏加德罗定律,反应前后瓶内压强不变,因此活塞刚开启时液面不发生变化.但随着SO2分子的扩散,当SO2分子与水接触时被水溶解,这时乙瓶内开始出现负压,因此水缓慢地进入乙瓶,当SO2被全部溶解时,进入乙瓶的水的体积约占瓶体积的.又SO2遇水同样生成酸,石蕊也呈现红色.