(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
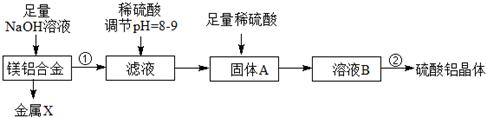
则镁铝合金中加NaOH溶液的化学反应方程式为 ,金属X是 ,
固体A的化学式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称 ,需要测定的数据有 。(已知该实验时的温度压强)

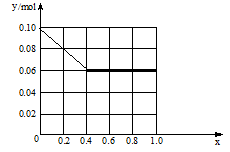
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为 mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。

(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑, Mg, Al(OH)3 ,冷却结晶(降温结晶)(4分)
(2)水槽 ,氢气的体积、镁铝合金的质量(温度、大气压强)答(到前2个条件给满分)。
(1+2分,共3分)
(3)0.06mol 如图(1+2分,共3分)
题目分析:(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝被碱液溶解后剩余固体金属镁,X为金属镁;加稀硫酸调节pH值为8.9,此时发生的反应:AlO2-+H++H2O= Al(OH)3↓;加足量稀硫酸:Al(OH)3+3H+=Al3++3H2O;操作②为浓缩、蒸发、过滤、干燥。
(2)仪器甲为水槽,测量量筒收集的气体体积,镁铝合金的质量。
(3)所涉及的反应:Al3++3OH-=Al(OH)3,Fe3++3OH-=Fe(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;铝离子物质的量为:0.04mol;铁离子物质的量为:0.06mol;得到沉淀物质的量最大时为0.1mol,此时耗掉氢氧根物质的量为:0.3mol,此时氢氧根物质的量还有0.04mol,0.04molOH-,可溶解氢氧化铝沉淀物质的量为0.04mol,最后的沉淀物质的量为0.06mol:
