在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
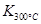 >
>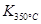 ,则该反应是 热反应。
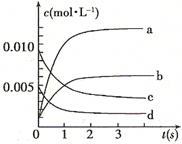
,则该反应是 热反应。(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)K=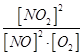 放热 (2)b 1.5×10-3mol·L-1·s-1 (3)bc (4)c
放热 (2)b 1.5×10-3mol·L-1·s-1 (3)bc (4)c
题目分析:(1)化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是K=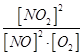 ;
;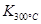 >
>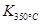 ,这说明升高温度平衡向逆反应方向移动,所以正反应是放热反应。
,这说明升高温度平衡向逆反应方向移动,所以正反应是放热反应。
(2)根据表中数据可知,平衡时NO2的浓度是(0.020mol-0.007mol)÷2L=0.0065mol/L,所以表示NO2的变化的曲线的是b;从0~2 s内消耗NO是(0.020mol-0.008mol)=0.012mol,所以消耗氧气是0.0132mol÷2=0.006mol,因此用氧气表示的反应速率是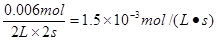 。
。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此a中的关系始终是成立,不正确;正反应是体积减小的可逆反应,所以压强也是减小的,b正确;c中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,d不正确,所以答案选bc。
(4)及时分离出NO2气体,浓度降低,反应速率降低,a不正确;正反应是放热反应,升高温度平衡向逆反应方向移动,b不正确;增大O2的浓度反应速率增大,且平衡向正反应方向移动,c正确;催化剂不能改变平衡状态,d不正确,答案选c。
点评:本题属于基本理论中化学平衡问题,主要考查学生对平衡移动等有关内容理解和掌握程度;题目推陈出新,难度适中,对概念的内涵和外延理解不深刻的考生容易出现失误,非常符合素质教育的要求。
