工业上,将黄铜矿(CuFeS2)通过8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
(1)上述反应中,还原剂为 。
(2)黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了 (写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
(3)对上述炉渣中进行含铁量的测定步骤如下:
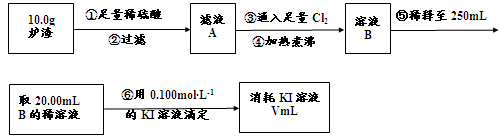
I.步骤③发生反应的离子方程式为 。
II.步骤④中煮沸的作用是 。
III.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
IV.若滴定过程中消耗0.100mol·L−1KI溶液20.00mL,则炉渣中铁的百分含量为 。
(1)CuFeS2 (2)a.[Al(OH)4]-或AlO2- b.稀硫酸、酸性KMnO4溶液;稀硫酸浸取炉渣所得溶液使酸性KMnO4溶液褪色(3)I.2Fe2++Cl2= 2Fe3++2Cl-II.赶走溶液中溶解的过量的Cl2 III.250mL容量瓶 (未答“250mL”不给分)IV.14%
题目分析:(1)在反应中CuFeS2中铁元素的化合价由+2价变为+3价,硫元素的化合价由-2价变为+4价做还原剂;(2)①用稀盐酸浸取炉渣发生的反应为:Al2O3 + 6H+=2Al3+ + 3H2O
FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O ②滤液中含有的金属阳离子有Al3+、Fe2+和Fe3+,氧化后含有Al3+和Fe3+,加过量氢氧化钠溶液发生的反应:Al3+ + 4OH-=AlO2- + 2H2O Fe3+ + 3OH- = Fe(OH)3↓ a、通过上述②,炉渣中的Al2O3变成了AlO2-;b验证炉渣中含有+2价的铁,应先加入稀硫酸溶解,生成亚铁离子,具有还原性,可与高锰酸钾发生氧化还原反应,酸化时不能加入盐酸,否则与高锰酸钾发生氧化还原反应,也不能直接加入硝酸,否则生成铁离子,不能检验,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液含有亚铁离子,与高锰酸钾发生氧化还原反应而使高锰酸钾褪色,故答案为:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色;(3)分析工艺流程图发生的反应为:炉渣加足量稀硫酸:Al2O3 + 6H+=2Al3+ + 3H2O FeO + 2H+ = Fe2+ + H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O过滤,滤液中含有的金属阳离子有Al3+、Fe2+和Fe3+,通入足量Cl2:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 滴定原理:2Fe3+ + 2I- = 2Fe2+ + I2I.步骤③通入足量氯气发生反应的离子方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ;II.过量的氯气能氧化I-,会影响实验结果,所以步骤④中煮沸的作用是赶走溶液中溶解的过量的Cl2;。III.步骤⑤为溶液的配制,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶。IV.滴定过程中发生的反应为2Fe3+ + 2I- = 2Fe2+ + I2,由反应式知n(I-)= n(Fe3+)=0.002mol,结合流程图知10.0g炉渣中铁的物质的量为0.025mol,质量为1.4g,质量分数为14%。
