二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
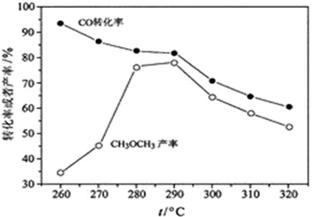
(4)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是 。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW•h•kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 ,一个二甲醚分子经过电化学氧化,可以产生 个电子的能量;该电池的理论输出电压为1.20V,能量密度E = (列式计算。能量密度=电池输出电能/燃料质量,1 kW•h = 3.6×106J)。
(1)Al2O3(铝土矿) + 2NaOH + 3H2O = 2NaAl(OH)4
NaAl(OH)4 + CO2 = Al(OH)3↓ + NaHCO3,2Al(OH)3 Al2O3+ 3H2O
Al2O3+ 3H2O
(2)消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g) + 4H2(g) = CH3OCH3 + H2O(g) △H = -204.7kJ•mol-1
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加。压强升高使CO和H2浓度增加,反应速率增大。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3 + 3H2O = 2CO2 + 12H+ + 12e- 12
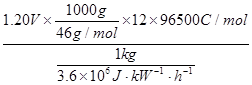 =8.39kW·h·kg-1
=8.39kW·h·kg-1
(1)从铝土矿制备较高纯度Al2O3的主要工艺流程:铝土矿用氢氧化钠溶液溶解,Al2O3+ 2NaOH + 3H2O = 2NaAl(OH)4,铝元素在溶液中以NaAl(OH)4存在,在溶液中通入二氧化碳气体进行酸化,NaAl(OH)4 + CO2 = Al(OH)3↓ + NaHCO3,过滤得到Al(OH)3沉淀,高温煅烧,2Al(OH)3 Al2O3+ 3H2O,得到较高纯度Al2O3。
Al2O3+ 3H2O,得到较高纯度Al2O3。
(2)根据四个反应方程式可知:二甲醚合成反应(iV)中消耗甲醇,促进甲醇合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)消耗部分CO。
(3)根据题目所给条件和盖斯定律,由H2和CO直接制备二甲醚的热化学方程式为2CO(g) + 4H2(g) = CH3OCH3 + H2O(g) △H = -204.7kJ•mol-1。该反应为分子数减少的反应,增加压强使平衡右移,CO和H2转化率均增大,CH3OCH3产率增加。增加压强使CO和H2浓度增加,反应速率增大。
(4)由H2和CO直接制备二甲醚,由于该反应是放热反应,随温度升高,平衡逆向移动,CO转化率随温度升高而降低。
(5)根据反应产物,二甲醚直接燃料电池的负极反应为CH3OCH3+3H2O-12e-=
2CO2+12H+,根据方程式可知:一个二甲醚分子经过电化学氧化,可以产生12个电子的能量;根据能量密度的计算公式,E = 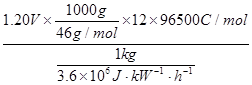 =8.39kW·h·kg-1。
=8.39kW·h·kg-1。
【考点定位】反应速率、化学平衡、电化学、化学计算
