A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
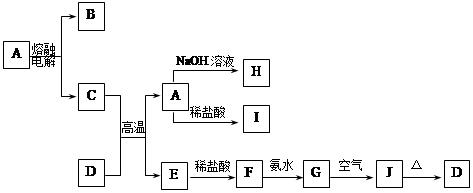
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
(1)Al2O3 、难溶
(2)AlO2-+CO2+H2O═Al(OH)3↓+HCO3-,4Fe(OH)2+2H2O+O2═4Fe(OH)3,
(3)Fe3++3H2O⇌Fe(OH)3+3H+
题目分析:(1)A是一种高熔点物质,可在高温下电解,应为氧化铝,则B为O2,D是一种红棕色固体,应为Fe2O3,与Al发生铝热反应,则E为Fe,根据反应关系可知H为NaAlO2,I为AlCl3,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3。故A的化学式为Al2O3 ,水中的溶解性为难溶。
(2)根据上述可知H为NaAlO2,GFe(OH)2。为故H溶液中通入过量的CO2的离子方程式是AlO2-+CO2+H2O═Al(OH)3↓+HCO3-,G→J的化学方程式为为4Fe(OH)2+2H2O+O2═4Fe(OH)3,反应现象为由白色变为灰绿色,最终变为红褐色沉淀。
(3)D物质恰好溶于一定量的稀盐酸后生成氯化铁溶液,因水解溶液显酸性,则Fe3++3H2O⇌Fe(OH)3+3H+,故答案为:Fe3++3H2O⇌Fe(OH)3+3H+。
