从含有Ag+、Fe3+和Al3+的溶液中,按下图所示方法分离提取金属单质
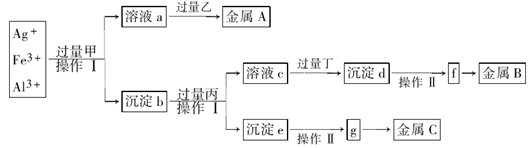
已知:实验时甲、乙、丙、丁四种物质只能从碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中选择,也可用这四种溶液来制取。对该实验过程的分析正确的是
A.丙是NaOH,丁是稀H2SO4
B.乙是葡萄糖,利用乙的还原性将金属A从溶液a中还原出来
C.操作I是过滤和洗涤沉淀。洗涤沉淀的方法是将漏斗中的沉淀转移到小烧杯中,加蒸馏水浸没沉淀,用玻璃棒搅拌,然后将水倒出,重复2-3次
D.g是氧化物,金属c采用电解法获得
答案:B
题目分析:向某溶液中加入碳酸铵、氢氧化钠、稀硫酸、葡萄糖四种溶液中的一种溶液,能产生金属单质,则加入的物质应该有还原性,乙只能为葡萄糖溶液。溶液a中应该含有Ag(NH3)2+.所以甲溶液为NH3 .它是由(NH4)2CO3与NaOH共热制取的。反应的方程式为:(NH4)2CO3+2NaOH Na2CO3+ 2NH3↑ + 2H2O。沉淀b为Fe(OH)3和Al(OH)3. 由于Al(OH)3是两性物质,能够被过量的强碱溶液溶解,而Fe(OH)3不能与强碱发生反应,可以通过过滤分离开。因此丙是NaOH溶液。溶液c为NaAlO2,沉淀e为Fe(OH)3。向NaAlO2溶液中加入过量的丁产生沉淀d,因为Al(OH)3两性,只能与强酸、强碱反应,而与弱酸、弱碱吧反应,所以丁应该是CO2;沉淀d是Al(OH)3。丁是由(NH4)2CO3与H2SO4反应制取的。反应的方程式为:(NH4)2CO3+ H2SO4= (NH4)2SO4+ CO2↑ + H2O。将沉淀d过滤出来,洗涤、干燥,然后加热发生分解反应:2Al(OH)3
Na2CO3+ 2NH3↑ + 2H2O。沉淀b为Fe(OH)3和Al(OH)3. 由于Al(OH)3是两性物质,能够被过量的强碱溶液溶解,而Fe(OH)3不能与强碱发生反应,可以通过过滤分离开。因此丙是NaOH溶液。溶液c为NaAlO2,沉淀e为Fe(OH)3。向NaAlO2溶液中加入过量的丁产生沉淀d,因为Al(OH)3两性,只能与强酸、强碱反应,而与弱酸、弱碱吧反应,所以丁应该是CO2;沉淀d是Al(OH)3。丁是由(NH4)2CO3与H2SO4反应制取的。反应的方程式为:(NH4)2CO3+ H2SO4= (NH4)2SO4+ CO2↑ + H2O。将沉淀d过滤出来,洗涤、干燥,然后加热发生分解反应:2Al(OH)3 Al2O3+ 3H2O.得到固体f: Al2O3.再电解Al2O3即得到金属B:Al. 2Al2O3
Al2O3+ 3H2O.得到固体f: Al2O3.再电解Al2O3即得到金属B:Al. 2Al2O3 4Al+3O2↑.将沉淀e Fe(OH)3过滤出来,洗涤、干燥,然后加热发生分解反应:2Fe(OH)3
4Al+3O2↑.将沉淀e Fe(OH)3过滤出来,洗涤、干燥,然后加热发生分解反应:2Fe(OH)3 Fe2O3+ 3H2O.得到固体g: Al2O3.再用CO还原Al2O3即得到金属C:Fe。3CO+Al2O3
Fe2O3+ 3H2O.得到固体g: Al2O3.再用CO还原Al2O3即得到金属C:Fe。3CO+Al2O3 2Fe+ 3CO2.通过上述分析可知正确选项为B.
2Fe+ 3CO2.通过上述分析可知正确选项为B.
