问题
填空题
将一定质量的Mg和Al的混合物投入2.0 mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。回答下列问题:
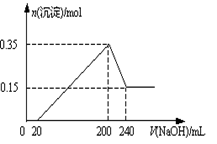
(1)由图可知加入镁的物质的量是 _____________________。
(2)当加入NaOH溶液的体积小于20mL时发生的离子反应是__________,当加入NaOH溶液的体积大于200 mL时发生的离子反应是______________。
(3)NaOH溶液的物质的量浓度为______________________。
答案
(1)0.15 mol
(2)H++OH—= H2O Al(OH)3+ OH—=AlO2— +2 H2O。
(3)5 mol/L或5.0 mol/L
题目分析:(1)因为最后的沉淀都为氢氧化镁为0.15mol,所以加入镁的物质的量为0.15mol;
(2)当氢氧化钠溶液的体积小于20mL时,中和溶液中的氢离子,因为此时并无沉淀生成,当氢氧化钠溶液的体积大于200mL后,氢氧根离子就会和氢氧化铝沉淀发生反应生成偏铝酸离子;
(3)设氢氧化钠的物质的量浓度为X,有Ymol的铝,则有:
0.15+Y/2*3+0.02X/2=2.0*0.25
0.15*2+4Y=(0.24-0.02)*X
解得:X=5 Y=0.2
