下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:
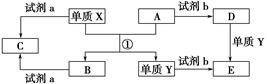
(1)请写出反应①的化学方程式___________________________________________。
(2)检验D溶液中Y离子的方法是_____________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是_____________________________________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
(1)Fe2O3+2Al 2Fe+Al2O3
2Fe+Al2O3
(2)取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液变红色,则证明有Fe3+
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)2FeSO4+H2SO4+2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑
(5)54
根据题意A为Fe2O3,X为铝,通过铝热反应生成氧化铝(B)和铁(单质Y);D与Fe反应生成E,则试剂b为盐酸,D、E分别是铁盐和亚铁盐。(4)E为FeSO4(铁的化合价为+2价)→Fe(OH)SO4(铁的化合价为+3价),而NaNO2(氮的化合价为+3价)→NO(氮的化合价为+2价)。根据电子得失守恒、质量守恒定律即可配平反应化学方程式。(5)阳极反应:2O2--4e-=O2↑,33.6 m3的氧气物质的量为1 500 mol,转移电子数为6 000 mol,阴极反应:Al3++3e-=Al,故可以得到2 000 mol的Al,质量为:2 000 mol×27 g·mol-1=54 000 g=54 kg。
