某工业废渣的主要成分为SiO2、Fe2O3、Al2O3、MgO。现根据下列方案对其进行处理以回收废渣中的金属元素。

回答下列问题。
(1)固体A的化学式为 。
(2)反应a的化学反应方程式为 。
(3)25 ℃时,溶液中金属离子的物质的量浓度与溶液pH的关系如图所示:
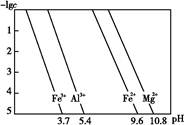
①调节pH(Ⅰ)的pH为 ;
②溶液D加入氢氧化钠溶液的同时调节pH(Ⅱ)所发生反应的离子方程式为 ;
③从图中数据计算可得Mg(OH)2的溶度积Ksp[Mg(OH)2]约为 。
(1)SiO2
(2)NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3
Al(OH)3↓+NaHCO3
(3)①3.7 ②Al3++4OH- Al
Al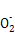 +2H2O、Mg2++2OH-
+2H2O、Mg2++2OH- Mg(OH)2↓ ③10-11.4
Mg(OH)2↓ ③10-11.4
(1)SiO2、Fe2O3、Al2O3、MgO中只有二氧化硅不溶于盐酸,所以A是二氧化硅。(2)通入二氧化碳能生成沉淀的只有偏铝酸钠。(3)根据金属离子的物质的量浓度与溶液pH的关系,可知调节pH=3.7时Fe3+完全沉淀,而Al3+、Mg2+还没有开始沉淀,而pH=10.8时Mg2+完全沉淀,铝离子转变为Al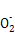 。当pH=10.8时镁离子完全沉淀,此时可以看做Mg2+浓度为10-5 mol/L,溶液中OH-浓度为10-3.2 mol/L,则有Ksp=c(Mg2+)·c2(OH-)=10-5×(10-3.2)2=10-11.4。
。当pH=10.8时镁离子完全沉淀,此时可以看做Mg2+浓度为10-5 mol/L,溶液中OH-浓度为10-3.2 mol/L,则有Ksp=c(Mg2+)·c2(OH-)=10-5×(10-3.2)2=10-11.4。
