铁和铝是生产和生活中最常见的两种金属,其单质和化合物被广泛应用。
(1)硫酸铁溶液可用于浸出黄铜矿精矿,其主要反应为:
CuFeS2+4Fe3+=Cu2++5Fe2++2S(CuFeS2中S为-2价,Fe为+2价)。
关于该反应,下列说法中,正确的是 (选填序号);
a.从物质分类的角度看,CuFeS2属于合金 b.反应过程中只有一种元素被还原
c.CuFeS2既作氧化剂又作还原剂 d.当转移1 mol电子时,产生16 g S
(2)高铁酸钾(K2FeO4)是一种新型水处理剂,在水中发生反应生成Fe(OH)3胶体。该反应中,高铁酸钾表现 (填“氧化性”或“还原性”),Fe(OH)3胶体具有净水作用,其原因是 。
(3)某同学取一张铝箔,并用针刺一些小孔,然后取一药匙过氧化钠粉末,用铝箔包好,放入右图所示装置内倒扣的漏斗中(图中铁架台和铁夹没有画出)。
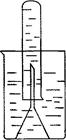
按顺序写出该过程中发生反应的离子方程式:
① ;
② 。
(1)(2分)bd (2)(2分)氧化性;胶体具有很大的表面积,吸附性强,可以使水中的悬浮物形成沉淀而析出,因此氢氧化铁胶体具有净水作用
(3)(4分)①2Na2O2 + 2H2O=4Na+ + 4OH— + O2↑ ②2A1 + 2OH— + 6H2O=2[A1(OH)4]— + 3H2↑
题目分析:(1)a、合金是由金属和金属或金属与非金属融合而成的具有金属特性的物质,因此合金属于混合物。所以从物质分类的角度看,CuFeS2不属于合金,而是化合物,a不正确;b、根据方程式CuFeS2+4Fe3+=Cu2++5Fe2++2S可知,反应中硫元素的化合价从-2价升高到0价,失去2个电子,因此CuFeS2是还原剂。铁离子中铁元素的化合价从+3价降低到+2价,得到1个电子,铁离子是氧化剂,因此反应过程中只有一种元素,即铁元素被还原,b正确;c、CuFeS2只作还原剂,c不正确;d、每生成2molS时反应中就转移4mol电子,所以当转移1 mol电子时,产生0.5molS,质量为16 g S,d正确,答案选bd。
(2)高铁酸钾中铁元素的化合价从+6价降低到+3价,得到电子,发生还原反应,因此高铁酸钾表现出氧化性;由于胶体具有很大的表面积,吸附性强,可以使水中的悬浮物形成沉淀而析出,因此氢氧化铁胶体具有净水作用。
(3)由于过氧化钠溶于水生成氢氧化钠和氧气,而铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,所以有关反应的离子方程式分别为2Na2O2 + 2H2O=4Na+ + 4OH— + O2↑、2A1 + 2OH— + 6H2O=2[A1(OH)4]— + 3H2↑。