铝灰的回收利用方法很多,现用含有Al2O3,SiO2和少量FeO xFe2O3的铝灰制备Al2(S04)3
xFe2O3的铝灰制备Al2(S04)3 18H2O,工艺流程如下:
18H2O,工艺流程如下:
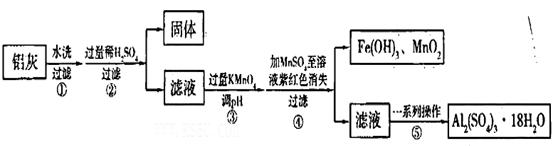
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是______________。
(2)流程中加人的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为_______________。
(3)已知:浓度均为O.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如下表:
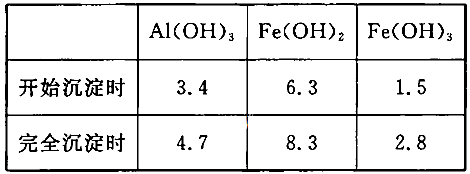
步骤③的目的是__________________________________________________________;若在该浓度下除去铁的化合物,调节pH的最大范围是___________。
(4)已知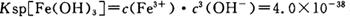 当pH=2时,Fe3+开始沉淀的浓度为_______________。
当pH=2时,Fe3+开始沉淀的浓度为_______________。
(5)操作④发生反应的离子方程式为__________________________________________;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是_________或_________。
(6)操作⑤“一系列操作",下列仪器中不需用的是___________(填序号)。
A.蒸发皿
B.坩埚
C.玻璃棒
D.酒精灯E.漏斗
(1)6H+ + Al2O3=2Al3+ + 3H2O (2)H2O2 + 2FeSO4 + H2SO4 =" Fe2(SO4)3" + 2H2O 。(3)将二价铁离子氧化三价铁离子,并通过调节PH值把三价铁离子转化为氢氧化铁沉淀除去。2.8到3.4。(4)4*10-2mol/L。(5)3Mn2+ + 2MnO4- + 4OH- ="5MnO2" + 2H2O ;浓盐酸;过氧化氢溶液。(6) B
题目分析:(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H+ + Al2O3=2Al3+ + 3H2O 。(2)流程中加人的KMnO4也可用H2O2代替,H2O2有强氧化性把二价铁离子氧化为三价铁离子,发生反应的化学方程式为H2O2 + 2FeSO4 + H2SO4 =" Fe2(SO4)3" + 2H2O 。(3)根据流程图可知是将二价铁离子氧化三价铁离子,并通过调节PH值把三价铁离子转化为氢氧化铁沉淀除去,确保铝离子不要沉淀出来,故调节pH范围为:2.8到3.4。(4)已知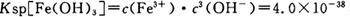 当pH=2时,即c(H+)=0.01Mmol/L,c(OH-)=10-12Mmol/L,代入
当pH=2时,即c(H+)=0.01Mmol/L,c(OH-)=10-12Mmol/L,代入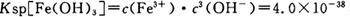 公式,可得Fe3+开始沉淀的浓度为4*10-2mol/L。(5)根据操作中出现的现象,紫色消失,说明高锰酸根离子参加了反应,④发生反应的离子方程式为3Mn2+ + 2MnO4- + 4OH- ="5MnO2" + 2H2O ;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是_浓盐酸并加热或过氧化氢溶液有气泡产生即可说明。(6)操作⑤“一系列操作"中有,蒸发浓缩,降温结晶,过滤,不需用的是 B.坩埚。
公式,可得Fe3+开始沉淀的浓度为4*10-2mol/L。(5)根据操作中出现的现象,紫色消失,说明高锰酸根离子参加了反应,④发生反应的离子方程式为3Mn2+ + 2MnO4- + 4OH- ="5MnO2" + 2H2O ;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是_浓盐酸并加热或过氧化氢溶液有气泡产生即可说明。(6)操作⑤“一系列操作"中有,蒸发浓缩,降温结晶,过滤,不需用的是 B.坩埚。
