某地有丰富的铝土矿和石灰石资源,拟用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)为原料冶炼铝,工艺流程如下图所示:
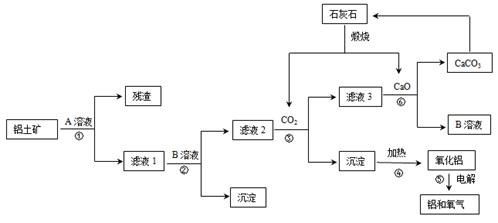
(1)原料A的名称是 ,可循环使用的物质的化学式式为 。
(2)如果省去步骤①,即溶解铝土矿从直接加入B溶液开始,则最终会对氧化铝的生产产生的影响是 。
(3)写步骤③的离子方程式 。
(4)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,写出阴极的电极反应方程式 。
(5)工业常用阳极氧化法使铝的表面生成致密的氧化膜。如右图是铝阳极氧化实验装置图:a端是电源的 极。铝片表面形成氧化铝的原理是(用电极方程式表示) , (填“能”或“不能”)用较浓NaCl溶液代替20%H2SO4作电解液进行铝的阳极氧化,若不能,请说明理由 。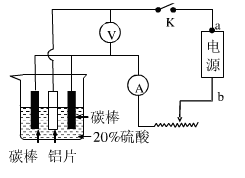
(1)盐酸(或硫酸)(1分) CaCO3和NaOH(2分)
(2)生成的氧化铝中含有二氧化硅杂质(2分)
(3)2AlO2-+CO2+3H2O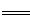 2Al(OH)3↓+CO32-(2分)(或AlO2-+CO2+2H2O
2Al(OH)3↓+CO32-(2分)(或AlO2-+CO2+2H2O Al(OH)3↓+HCO3-)
Al(OH)3↓+HCO3-)
(4)Al3++3e- Al(2分)
Al(2分)
(5)正(1分) 2Al-6e-+3H2O Al2O3+6H+(2分) 不能(1分) 若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
Al2O3+6H+(2分) 不能(1分) 若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
题目分析:(1)SiO2和盐酸不反应,Fe2O3和氢氧化钠不反应而氧化铝能反应,向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀。由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-.步骤②应加入氢氧化钠除去铁离子,将铝离子转化为AlO2-,所以滤液①中含有Al3+,步骤①应为加入盐酸,除去SiO2。
滤液①中含有Al3+、Fe3+、Cl-、H+等,加入氢氧化钠,除去铁离子、氢离子,将铝离子转化为AlO2-,滤液2含有AlO2-,Cl-、Na+、,通入二氧化碳将偏铝酸根离子转化为氢氧化铝,所以滤液3中的离子主要有Na+、OH-、Cl-、HCO3-,步骤③通入二氧化碳与AlO2-反应生成的沉淀为氢氧化铝,反应化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,CaCO3 CaO+CO2↑,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钠反应,NaHCO3+Ca(OH)2═CaCO3↓+NaOH+H2O,所以NaOH、CaCO3可再次被利用,即可循环使用。
CaO+CO2↑,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸氢钠反应,NaHCO3+Ca(OH)2═CaCO3↓+NaOH+H2O,所以NaOH、CaCO3可再次被利用,即可循环使用。
(2)如果省去步骤①,即溶解铝土矿是从加入原料B开始,用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质。
(3)步骤③通入二氧化碳与AlO2-反应生成的沉淀为氢氧化铝,二氧化碳少量时离子方程式为2AlO2-+CO2+3H2O 2Al(OH)3↓+CO32-,二氧化碳过量时离子方程式为AlO2-+CO2+2H2O
2Al(OH)3↓+CO32-,二氧化碳过量时离子方程式为AlO2-+CO2+2H2O Al(OH)3↓+HCO3-
Al(OH)3↓+HCO3-
(4)三氧化铝熔融时电离出O2-和Al3+,阳离子在阴极放电,所以阴极的电极反应方程式Al3++3e- Al。
Al。
(5)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al-6e-+3H2O Al2O3+6H+,所以a端是电源的正极,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-
Al2O3+6H+,所以a端是电源的正极,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e- 3H2。 不能用较浓溶液代替20%H2SO4作电解液进行铝的阳极氧化,若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
3H2。 不能用较浓溶液代替20%H2SO4作电解液进行铝的阳极氧化,若用NaCl溶液代替硫酸,阳极会有Cl-放电产生Cl2,无法使其表面生成致密的氧化膜(其他合理答案均给分,2分)
