问题
选择题
在醋酸中存在电离平衡:CH3COOH 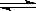 CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
A.加水
B.加热
C.加CH3COONa固体
D.加很稀的NaOH溶液
答案
BC
题目分析:在醋酸中存在电离平衡:CH3COOH 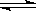 CH3COO-+H+,要使溶液中的c(CH3COO-)提高,可以加入可以提供CH3COO-的盐,故选C,加热可以使平衡向吸热方向移动,故选B,加水会稀释使浓度降低;加很稀的NaOH溶液,同样相当于稀释;故选BC。
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,可以加入可以提供CH3COO-的盐,故选C,加热可以使平衡向吸热方向移动,故选B,加水会稀释使浓度降低;加很稀的NaOH溶液,同样相当于稀释;故选BC。
点评:以下列表归纳了外界条件变化对电离平衡及c(H+)的影响,这里假设弱电解质AB可以电离成(A+)和(B-),且电离过程吸热,
则
| 电离方程式 | AB=(可逆反应)=(A+)+(B-) | |
| 条件改变内容 | v(正),v(逆)关系 | 平衡移动方向 |
| 增大c(AB) | v(正)>v(逆) | 向右 |
| 减小c(AB) | v(正)<v(逆) | 向左 |
| 增大c(A+) | v(正)<v(逆) | 向左 |
| 减小c(A+) | v(正)>v(逆) | 向右 |
| 增大c(B—) | v(正)<v(逆) | 向左 |
| 减小c(B—) | v(正)>v(逆) | 向右 |
| 稀释溶液 | v(正)>v(逆) | 向右 |
| 升高温度 | v(正)>v(逆) | 向右 |
| 降低温度 | v(正)<v(逆) | 向左 |
