某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)取样品a g,称取时使用的仪器名称为 。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有 ;滤渣中含有 ;在溶解过滤时使用的主要玻璃仪器有 。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的化学方程式 。
(4)在第(3)步的滤液中通入足量CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至重量不再减少为止,冷却后称量,质量为b g。有关反应的化学方程式为 。
(5)该样品中铝的质量分数的表达式为 。
(1)托盘天平
(2)MgCl2、AlCl3 Cu、Si 漏斗、烧杯、玻璃棒
(3)MgCl2+2NaOH=Mg(OH)2↓+2NaCl, AlCl3+3NaOH=Al(OH)3↓+3NaCl, Al(OH)3+NaOH=NaAlO2+2H2O
(4)NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓ 2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
(5)  ×100%
×100%
用酸溶解硬铝时,铜、硅成为滤渣,滤液成分为MgCl2、AlCl3;滤液中加入足量NaOH后,过滤,滤渣为Mg(OH)2,滤液中溶质主要是NaAlO2,滤液中通入足量CO2后析出Al(OH)3,Al(OH)3烘干灼烧成为Al2O3,由关系式:2Al~Al2O3
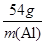 =
= ,m(Al)=
,m(Al)=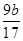 g
g
Al的质量分数为: ×100%
×100%
