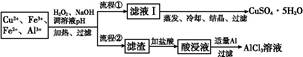
某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液:
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
(1)加入H2O2的作用是 ,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至 。
(2)写出H2O2与Fe2+反应的离子方程式: 。
(3)流程②中加入适量Al粉起的作用是 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3 (填“能”或“不能”),原因是 。
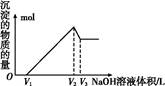
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)= 。
(1)将Fe2+氧化为Fe3+ 5.0
(2)2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
(3)与酸浸液中Fe3+和H+反应生成Al3+
(4)不能 直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝 (5)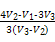
(1)由相关金属离子沉淀,pH范围图表可知:Fe2+与Cu2+沉淀pH范围存在交叉,不易除去,故加入H2O2将Fe2+氧化为Fe3+,可避免这一问题,并且调节pH为5.0,可以将Al3+与Fe3+同时除去。
(2)H2O2与Fe2+反应的离子方程式为:H2O2+2Fe2++2H+ 2Fe3++2H2O。
2Fe3++2H2O。
(3)由流程图可知,滤渣是Fe(OH)3与Al(OH)3的混合物,加盐酸溶解后得到的是含FeCl3、AlCl3、HCl的混合物,为了得到较纯的AlCl3溶液,加入适量Al可以将FeCl3与HCl反应掉。
(4)AlCl3溶液中存在水解平衡:AlCl3+3H2O Al(OH)3+3HCl,加热蒸发时,HCl会挥发造成平衡右移,最终得不到AlCl3。
Al(OH)3+3HCl,加热蒸发时,HCl会挥发造成平衡右移,最终得不到AlCl3。
(5)NaOH溶液的物质的量浓度为a,据图像可知:
V1~V2段发生反应为:
Al3++3OH- Al(OH)3↓,
Al(OH)3↓,
Fe3++3OH- Fe(OH)3↓;
Fe(OH)3↓;
V2~V3段发生反应为:
Al(OH)3+OH- Al
Al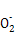 +2H2O,
+2H2O,
据此可求出n(Al3+)=a(V3-V2),
n(Fe3+)=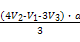 ,
,
故n(Fe3+)∶n(Al3+)=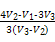 。
。
