(13分)(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。
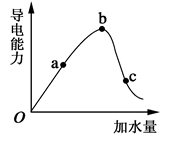
(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数
(1)0.1 mol/L 1 10-13 mol/L (2)因为冰醋酸未电离,无自由移动的离子
(3)c<a<b (4)c (5)B、C、D、E (6)A、C
题目分析:(1)0.05mol/L硫酸溶液中c(H+)=0.1 mol/L,pH值为1,水电离的c(H+)为10-13 mol/L。
(2)在O点醋酸没有电离,只有醋酸分子,无自由移动的离子,所以不能导电。
(3)氢离子浓度越大,导电能力越强,所以根据图像可知氢离子浓度的大小顺序为b>a>c。
(4)醋酸是弱酸,存在电离平衡,稀释促进电离,所以c点醋酸的电离程度最大。
(5)根据CH3COOH CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
CH3COO-+H+,加NaCl溶液,平衡不移动c(CH3COO-)不变,加热平衡正向移动,c(CH3COO-)增大,加固体KOH,平衡正向移动,c(CH3COO-)增大,加Zn粒,平衡正向移动,c(CH3COO-)增大,加固体CH3COONa,平衡逆向移动,但c(CH3COO-)增大,加水平衡正向移动,但c(CH3COO-)减小。所以能使c(CH3COO-)增大的措施是BCDE。
(6)根据CH3COOH CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=
CH3COO-+H+,稀释过程中平衡正向移动,H+个数增加,c(H+)减小,c(CH3COO-)减小,CH3COOH分子数减小,根据K=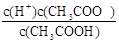 ,c(CH3COO-)减小,所以
,c(CH3COO-)减小,所以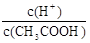 增大。因此选AC。
增大。因此选AC。
点评:本题综合性较强,难度较大,主要要运用好平衡常数。