问题
选择题
在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图一,C的百分含量与温度的关系如图二。
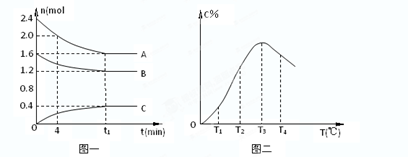
下列分析不正确的是:( )
A.此反应的正反应为吸热反应
B.由T1向T2变化时,V正> V逆
C.增大压强,平衡向正反应方向移动
D.0~4分钟时,A的速率为0.01mol/(L•min)
答案
答案:A
题目分析:根据图二可知,当C的含量达到最大值时,即反应达到平衡状态时。如果继续升高温度,C的含量反而是降低的。二根据图一可知,A和B是反应物,C是生成物。这说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,选项A不正确;温度越高,反应速率越大,B正确;根据图一可知,该反应的方程式是2A+B C,即正反应是体积减小的,C正确;0~4分钟时,A的变化量是0.4mol,所以A的反应速率是
C,即正反应是体积减小的,C正确;0~4分钟时,A的变化量是0.4mol,所以A的反应速率是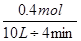 =0.01mol/(L•min),D正确,答案选A。
=0.01mol/(L•min),D正确,答案选A。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。 二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
