问题
填空题
利用反应Zn+2FeCl3═ZnCl2+2FeCl2设计一个原电池.在右边方格内画出实验装置图,并指出正极为______,电极反应式为______;负极为______,电极反应式为______.
答案
由反应“Zn+2FeCl3═ZnCl2+2FeCl2”可知,反应中Zn被氧化,应为原电池负极,失电子而被氧化,
电极反应为Zn-2e-=Zn2+,正极应为活泼性比Zn弱的金属或非金属材料,Fe3+在正极得到电子而被还原,
电极反应式为Fe3++e-=Fe2+,电解质溶液为FeCl3,实验装置图可设计如下:
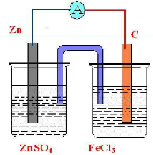
,
故答案为:C;Fe3++e-=Fe2+;Zn;Zn-2e-=Zn2+;

.
