某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:
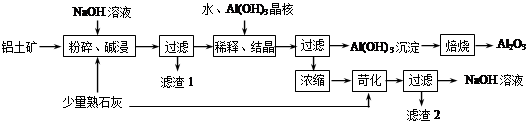
⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是 。
⑵AlO(OH)与NaOH反应的化学方程式为 。
⑶在稀释、结晶过程中:稀释的目的是 ;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的 气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式: 。
⑸该生产流程能实现 (填化学式)的循环利用。
⑴加快反应的速率
⑵AlO(OH) +NaOH=NaAlO2+H2O
⑶促进NaAlO2的水解 CO2
⑷Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑸NaOH
题目分析:(1)高温有利于加快反应速率;(2)AlO(OH)与NaOH反应的同样应是偏铝酸钠,AlO(OH) +NaOH=NaAlO2+H2O;(3)该过程是通过NaAlO2的稀释生成Al(OH)3,没有其它反应物,故其应该是水解产生,稀释促进NaAlO2的水解,也可以用CO2与其反应利用强酸制弱酸生成氢氧化铝;(4)加入熟石灰生成碳酸钙除去;(5)NaOH碱浸时使用,最后过滤时产生,故是循环利用。
