(本题共15分)
有4种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁4位同学各取1种样品,进行下列实验,测定合金中镁的质量分数。
52.甲同学取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则样品①合金中镁的质量分数为_____________。
53.乙同学取样品②m2 g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m2 g。则样品②合金中镁的质量分数为____________。
54.丙同学取样品③m3 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为V L,则样品③中m3的取值范围是___________________________________________。
丁同学取不同质量的样品④分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体体积(已转化为标准状况)如下:
| 实验序号 | a | b | c |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
56.通过计算求样品④中合金中镁的质量分数。
57.在c组实验后,还需向容器中加入1.0 mol·L-1的氢氧化钠溶液多少毫升才能使剩余合金中的铝恰好完全溶解?
52. 47.06% (2分)
53. 60% (2分)
54. 0.80V<m<1.07V
(2分,其它写法如27V/33.6<m<24V/22.4或9V/11.2<m<3V/2.8都给分)
55. 丙中盐酸反应完全,n(H2)="0.672/22.4" ="0.03" mol,(1分)
则c(HCl)="0.03×2/0.03=2.0" mol·L-1(1分)
56. 设合金中Mg、Al的物质的量分别为x、y,则有:
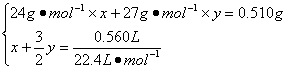
(1分)
解得:x =" y" =" 0.01" mol(1分)
则w(Mg)="[(0.01" mol×24 g·mol-1)/0.510 g]×100%=47.06%(1分)
57. 根据HCl ~ NaCl和Al ~ NaAlO2可知
n(NaCl)="n(HCl)=2.0" mol·L-1×0.030 L="0.06" mol(1分)
n(NaAlO2)="n(Al)=0.01" mol×918/510="0.018" mol(1分)
根据Na+守恒得:n(NaOH)="0.06" mol+0.018 mol="0.078" mol(1分)
故V(NaOH)="0.078" mol/1.0 mol·L-1="0.078" L="78" mL (1分)
即c组实验后还需加入78 mL的氢氧化钠溶液,才能使剩余合金中的铝恰好完全溶解。
题目分析:52.镁铝合金中铝与氢氧化钠反应产物经过二氧化碳反应所得沉淀过滤、洗涤、烘干、灼烧,得到固体为氧化铝,反应前为镁铝反应后为铝和氧,质量不变,根据元素守恒可知氧化铝中氧的质量分数即为镁的质量分数,为16×3/(16×3+27×2)= 47.06%;53.该反应得到的固体为氧化镁,根据元素质量守恒,氧化镁中镁元素的质量分数即是镁铝合金中镁元素的质量分数,为24/(24+16)= 60%;
54.镁铝与稀硫酸反应消耗的硫酸不同产生的气体量也不同,故采用极值法确定其范围,金属全为镁时
金属的量为V /22.4×24=1.07V,金属全为铝时V /22.4×2/3×27=0.80V,范围0.80V<m<1.07V;
55.丁同学实验数据中盐酸量固定,bc组盐酸反应完全,a组金属反应完全,故计算盐酸的浓度根据bc组气体数据直接得出,丙中盐酸反应完全,n(H2)="0.672/22.4" ="0.03" mol,
则c(HCl)="0.03×2/0.03=2.0" mol·L-1
56.根据a组数据列方程式可解,解法见答案;57.根据元素守恒,合金中铝最终变为NaAlO2,开始加入的盐酸最终变为氯化钠,此可称为终态分析法。
n(NaCl)="n(HCl)=2.0" mol·L-1×0.030 L="0.06" mol(氯原子守恒)
n(NaAlO2)="n(Al)=0.01" mol×918/510="0.018" mol(铝原子守恒)
根据Na+守恒得:n(NaOH)="0.06" mol+0.018 mol="0.078" mol
故V(NaOH)="0.078" mol/1.0 mol·L-1="0.078" L="78" mL (1分)
即c组实验后还需加入78 mL的氢氧化钠溶液,才能使剩余合金中的铝恰好完全溶解。
