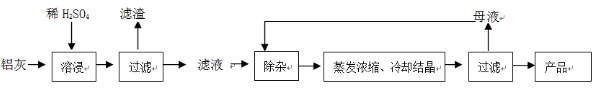
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下:
(一定条件下,MnO4- 可与Mn2+反应生成MnO2)
已知: 生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤。
①步骤Ⅰ的目的 ;调节溶液的pH为3.2的目的是 。
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是 ,写出其反应方程式 ;
③Ⅲ中加入MnSO4的目的是 。
(4)从多次循环使用后母液中可回收的主要物质是 (填化学式)。
(1)Al2O3+6H+=2Al3++3H2O
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色
(3)①将Fe2+氧化为Fe3+;调节pH值使铁完全沉淀;
②有黄绿色气体生成;MnO2+4HCl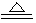 MnCl2+ Cl2↑+2H2O
MnCl2+ Cl2↑+2H2O
③除去过量的MnO4-。
(4)K2SO4。
(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
(2)取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色。
(3)①将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
②加入浓盐酸与MnO2反应生成有黄绿色气体;MnO2+4HCl= MnCl2+ Cl2↑+2H2O
③MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去。
(4)多次循环的物质是K2SO4。
