钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析。具体步骤如下图所示:
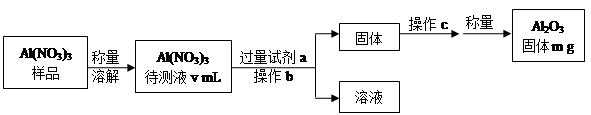
①加入试剂a后发生反应的离子方程式为 。
②操作b为 ,操作c为 。
③Al(NO3)3待测液中,c (Al3+) = mol·L-1(用m、v表示)。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
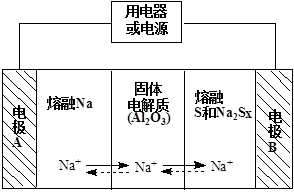
①根据下表数据,请你判断该电池工作的适宜温度应控制在 范围内(填字母序号)。
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100℃~300℃ c.300℃~350℃ d.350℃~2050℃
②放电时,电极A为 极。
③放电时,内电路中Na+的移动方向为 (填“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx="2Na" + xS(3<x<5),则阳极的电极反应式为 。
(1)① Al3++3NH3·H2O=Al(OH)3+3NH4+
②过滤洗涤 灼烧 冷却 ③1000m/51v
(2)① c ②负 ③ 从A到B ④ Sx-2e-=xS
(1)①根据操作流程可知实验原理是,Al(NO3)3和氨水反应生成Al(OH)3,离子方程式是Al3++3NH3。H2O=Al(OH)3+3NH4+。
②氢氧化铝经过滤、洗涤、灼烧后生成三氧化二铝,冷却后称量。
③ n(Al2O3)="m/102" mol,则n[Al(NO3)3]="2" n(Al2O3)="m/51" mol
c[Al(NO3)3]= n[]/10-3V="1000m/51v" mol/L;
(2)①原电池工作时,控制温度应满足Na和S处在熔融状态,则控制温度是低于444.6℃,高于115℃,选择c符合题意。
②原电池放电时,Na是负极被氧化。
③在原电池内部,阳离子向正极移动,即A到B;
④原电池充电时,是电解池变化,阳极反应为Sx-2e-=Xs
