无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)Cl-的电子式为 ________。Al在元素周期表最中的位置是________。
(2)生产中加入石油焦,其目的是_____________________________________。
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2 AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
____________________________________________________________。
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为 _____________________________________________________________。
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________、___________。
②AlCl3产品的纯度为__________________________________。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式__________________。
(1)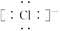 第三周期第IIIA族
第三周期第IIIA族
(2)碳与O2反应,有利于反应正向进行
(3)气体X可能为CO、CO2或两者的混合物。将生成气体依次通过澄清石灰水、灼热的CuO粉末,如溶液变浑浊,则X中存在CO2,如黑色CuO粉末变成红色粉末,则X中存在CO。
(4)Al + 3FeCl3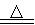 AlCl3+ 3FeCl2
AlCl3+ 3FeCl2
(5)①Fe3++3OH-===Fe(OH)3↓
Al3++4OH-===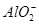 +2H2O
+2H2O
②96%
(6)①NaAlO2、Na2SiO3、NaOH
②Al3++3NH3·H2O ===Al(OH)3↓+3
(1)在写阴离子的电子式时注意不要忘记写中括号和中括号外的电荷符号。
(2)从生产无水AlCl3的化学方程式看,该反应为可逆反应,加入石油焦后,碳与O2反应,使可逆反应转化为不可逆反应,有利于反应正向进行。
(3)从Al2O3+C+Cl2 AlCl3+X↑可以看出X为CO、CO2或两者的混合物,确定气体X的成分,就是检验CO、CO2的存在
AlCl3+X↑可以看出X为CO、CO2或两者的混合物,确定气体X的成分,就是检验CO、CO2的存在
(4)Al 将FeCl3还原为FeCl2
(5)过程中涉及的离子方程式有AlCl3与过量的NaOH溶液的反应和FeCl3与NaOH溶液的反应,0.32 g残留固体质量是Fe2O3, 则n(Fe3+) = 0.004 mol,m(FeCl3)=0.65 g ,m(AlCl3)=15.6 g, AlCl3产品的纯度为15.6 g /16.25 g = 0.96
(6)过量NaOH溶液可以和铝土矿中的Al2O3和SiO2反应,不与Fe2O3反应
