某中学化学兴趣小组对乙醇的分子结构进行探究,
其过程如下:
猜想一:乙醇结构是CH3CH2OH
猜想二:乙醇结构是CH3OCH3
制定并实施方案:按右图所示实验装置,测定乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目.
试回答下列问题:
(1)指出实验装置中的错误______.
(2)如果实验装置和操作正确,且结论符合猜想一,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为:______.
(3)如果实验装置和操作正确,且结论符合猜想二,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为:______.
(4)如果实验装置正确,实验结果为2.3g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56L,则乙醇的结构应为______,理由是______.
(5)该实验获得成功的关键,除了需要纠正图中的装置错误以外,还需注意下列问题中的______(用序号填写).
①装置的气密性良好;②实验开始前准确测定乙醇的量;③钠足量;④广口瓶中水的体积大于560mL;⑤氢气的体积测算准确.
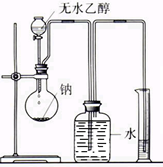
(1)利用排水测定生成氢气的体积,广口瓶中进气导管不应插入水中,排水导管应插到广口瓶底部,
故答案为:广口瓶中进气导管不应插入水中,排水导管应插到广口瓶底部;
(2)若乙醇结构是CH3CH2OH,令CH3CH2OH的物质的量为1mol;
只有羟基上的氢反应,根据氢原子守恒,生成氢气的物质的量为0.5mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:0.5;
只有甲基上的氢反应,根据氢原子守恒,生成氢气的物质的量为1.5mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:1.5;
只有亚甲基上的氢反应,根据氢原子守恒,生成氢气的物质的量为1mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:1;
若甲基、亚甲基上的氢反应,根据氢原子守恒,生成氢气的物质的量为2.5mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:2.5;
若甲基、羟基上的氢反应,根据氢原子守恒,生成氢气的物质的量为2mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:2;
若亚甲基、羟基上的氢反应,根据氢原子守恒,生成氢气的物质的量为1.5mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:1.5;
若甲基、亚甲基上、羟基的氢全部反应,根据氢原子守恒,生成氢气的物质的量为3mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:3;
故答案为:1:0.5; 1:1.5; 1:1; 1:2.5;1:2;1:3.
(3)若乙醇结构是CH3OCH3,令CH3OCH3的物质的量为1mol;
甲基上的氢全部反应,根据氢原子守恒,生成氢气的物质的量为3mol,参加反应的乙醇的物质的量与产生氢气的物质的量之比为1:3.
故答案为:1:3;
(4)2.3g乙醇的物质的量为
=0.05mol,2.3g 46g/mol
标准状况下0.56L氢气的物质的量为
=0.025mol,0.56L 22.4L/mol
所以每摩尔乙醇与钠反应提供的氢原子为
×0.025mol×2=1mol,1mol 0.05mol
所以,乙醇的结构应为CH3CH2OH,故答案为:CH3CH2OH;1mol乙醇中只有1mol活泼H;
(5)该实验原理是测出一定量乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,据此推断结构.
气密性好才能收集到气体;
乙醇的量,氢气的体积准确,定量计算结论才正确;
钠足量才能保证乙醇完全反应;
由于2.3g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56L,所以广口瓶中水的体积大于560mL;
故选:①②③④⑤.
