(14分)铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
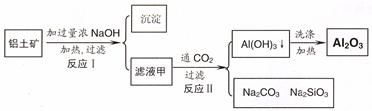
(1)滤液甲的主要成分是(写化学式)
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是 (填字母序号)
A.AlO2― B.OH― C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:
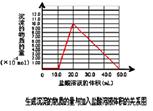
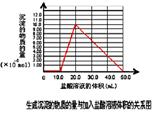
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为:
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。
⑴ NaOH、NaAlO2、Na2SiO3
⑵ CO2+2OH-==CO32-+2H2O CO2+2H2O +2 AlO2-==2Al(OH)3↓+HCO3-
⑶ b>a>c ⑷ Al(OH)3 +OH-=AlO2-+2H2O
⑸ ① H++OH-==H2O AlO2-+H++H2O =Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O
②图像如下所表示。
题目分析:(1)铝土矿中加入过量的NaOH溶液,其中的Al2O3、SiO2发生反应得到NaAlO2、Na2SiO3和过量的NaOH溶液,所以滤液甲的主要成分是NaAlO2、Na2SiO3、NaOH;不溶性的固体是Fe2O3。(2)向含有NaAlO2、Na2SiO3、NaOH的溶液中通入过量CO2,发生反应CO2+2OH-=CO32-+2H2O ;CO2+2H2O +2AlO2-==2Al(OH)3↓+HCO3-,得到Al(OH)3沉淀。(3)H2O是中性物质;Al(OH)3是两性物质,H2SiO3是弱酸。所以微粒结合质子 ( H+) 的能力,由强到弱的顺序是b>a>c。(4)向含有NaAlO2、Na2SiO3、NaOH的加入过量盐酸发生反应得到AlCl3、NaCl、H2SiO3;溶液为AlCl3、NaCl的混合溶液。用惰性电极电解,在阴极发生反应:2H++2e-=H2↑,由于破坏了附近的水的电离平衡,溶液中OH-的浓度增大,OH-与溶液中的Al3+发生反应形成Al(OH)3沉淀。在阳极发生反应:2Cl-—2e-=Cl2↑。当溶液呈碱性时,又发生反应:Al(OH)3+ OH-= AlO2-+ 2H2O。沉淀又逐渐溶解而消失。(5)①加入50.0mL 盐酸溶液发生的离子反应的先后顺序是H++OH-=H2O ;AlO2-+H++H2O =Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O 。 由于二者的物质的量相等,所以它们都是是0.100 mol/L×0.01L=0.001mol。NaOH与HCl反应消耗10mlHCl; NaAlO2与HCl反应形成Al(OH)3沉淀消耗10mlHCl;溶解Al(OH)3沉淀消耗30mlHCl.图像见图示: