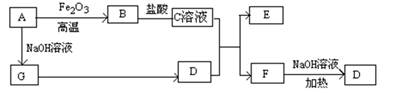
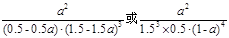已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式 ;
(2)①C溶液与D反应的离子方程式为 ;
②F溶液与NaOH溶���共热反应的化学方程式为 ;
(3)①请用离子方程式解释C溶液为何显酸性 ;
②F溶液中离子浓度由大到小的顺序为 ;
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)= mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度 (填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为 (用含a的代数式表示)
(1)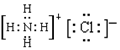
(2)① Al3++3NH3·H2O=Al(OH)3↓+3NH4+
②NH4Cl+NaOH=NaCl+NH3↑+H2O
(3)①Al3++3H2O Al(OH)3+3H+
Al(OH)3+3H+
②c(Cl-) > c(NH4+) > c(H+)>c(OH-)
(4)D
(5)①0.8 ②小于 ③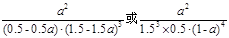
根据题目给定的信息机相应的转化关系可知:
A是Al;B是Al2O3;C是AlCl3;D是NH3;E是Al(OH)3;F是NH4Cl;G是H2。
(1)氯化铵是离子化合物,电子式是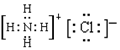 。
。
(2)①C溶液与D反应的离子方程式为:Al3++ 3NH3·H2O=Al(OH)3↓+3NH4+。
②F溶液与NaOH溶液共热反应的化学方程式为NH4Cl+NaOH NaCl+NH3↑+H2O。
NaCl+NH3↑+H2O。
(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
②由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+) > c(H+)>c(OH-)。
(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。铝分别与酸和碱反应的离子方程式为
2Al+6H+=2Al3++3H2↑ 2Al+2H2O+2OH-=2AlO2-+3H2↑
溶液n(Al)= 5.4g÷27g/mol=0.2mol,由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3 n(Al)=3×0.2mol=0.6mol,n(酸)=0.2×2mol=0.4mol, n(H+)="a" n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属会完全反应,不成立。所以选项为D。
(5)N2+3H2 2NH3在反应方程式中V(H2):V(NH3)=3:2,V(H2)= 1.2mol/(L·min),则V(NH3)=
2NH3在反应方程式中V(H2):V(NH3)=3:2,V(H2)= 1.2mol/(L·min),则V(NH3)=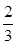 V(H2)=
V(H2)=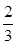 ×1.2mol/(L·min)="0.8" mol/(L·min)。
×1.2mol/(L·min)="0.8" mol/(L·min)。
②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为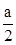 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于
mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于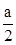 mol/L。
mol/L。
③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K=