问题
选择题
已知常温常压下, N≡N键的键能是946 KJ/mol 、N-H键的键能是391 KJ/mol、H-H 键的键能是436KJ/mol 。现有甲、乙两个容积相同的定容密闭容器,在常温下:①向密闭容器甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ。②向密闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是( )
A.92>Ql>2Q2
B.92=Q1<2Q2
C.Q1=2Q2=92
D.Q1=2Q2<92
答案
答案:A
题目分析:△H=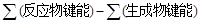 。N2(g)+3H2(g)
。N2(g)+3H2(g)  2NH3(g) △H=(946+3×436-391×6)kJ/mol=-92kJ/mol。可逆反应不能进行到底,1 mol N2和3 mol H2反应达到平衡时放出热量Q1<92kJ。容器乙中起始投料是容器甲中起始投料量的一半,容器乙相当于容器甲压强减小一半,平衡向左移动,所以2Q2<Q1。
2NH3(g) △H=(946+3×436-391×6)kJ/mol=-92kJ/mol。可逆反应不能进行到底,1 mol N2和3 mol H2反应达到平衡时放出热量Q1<92kJ。容器乙中起始投料是容器甲中起始投料量的一半,容器乙相当于容器甲压强减小一半,平衡向左移动,所以2Q2<Q1。
点评:△H=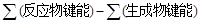 ;可逆反应不能进行到底。
;可逆反应不能进行到底。
