(14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
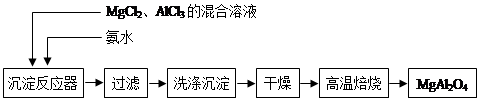
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。

(3)在25℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴 加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式 (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
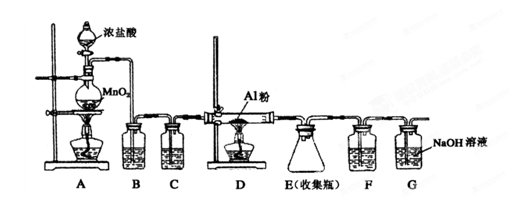
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(14分)(1)2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O(2分)
MgAl2O4 + 4H2O(2分)
(2)漏斗下端尖嘴未紧贴烧杯内壁(1分)AgNO3溶液(1分)坩埚(1分)
(3)Al(OH)3(1分) Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
(4)除去HCl(1分);吸收水蒸气(1分) 碱石灰(2分)
(5)4.00(2分)
题目分析:(1)MgCl2、AlCl3的混合溶液与氨水反应生成氢氧化镁和氢氧化铝沉淀,经过滤、洗涤、干燥后高温焙烧生成MgAl2O4,所以该反应的反应物是氢氧化镁和氢氧化铝,产物是MgAl2O4和水,化学方程式为2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O;
MgAl2O4 + 4H2O;
(2)过滤存在中符合“一贴二低三靠”过滤操作中的一处错误是漏斗下端尖嘴未紧贴烧杯内壁;氯化镁与氯化铝在与氨水反应生成沉淀时,沉淀上易附着有氯离子,检验氯离子所用的试剂是硝酸银溶液;高温焙烧时,用于盛放固体的仪器是坩埚;
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11>Ksp[Al(OH)3]=3×10-34。所以先生成溶解度小的沉淀Al(OH)3;生成Al(OH)3沉淀的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)因为无水AlCl3遇潮湿空气即产生大量白雾,所以制备氯化铝时要求氯气是干燥的,而且浓盐酸易挥发,挥发的HCl也与Al反应,所以需除去HCl,装置B中盛放饱和NaCl溶液,目的就是除去氯气中的HCl;装置C中盛放浓硫酸,目的是干燥氯气;F中也盛放浓硫酸,目的是吸收G中的水蒸气,防止水蒸气进入D中;可用一件仪器装填适当试剂后也可起到F和G的作用,该试剂既能吸收水,还能吸收多余的氯气,所以应该是碱石灰;
(5)Mg、Cu都是2价金属,沉淀的质量也即Mg、Cu的质量加上OH-的质量。该过程中生成NO气体0.896L(标准状况)物质的量是0.04mol,则Mg、Cu失去电子的物质的量等于NO3-得电子的物质的量也等于OH-的物质的量,即n(OH-)=0.04mol×3=0.12mol,所以沉淀的质量是1.96g+0.12mol×17g/mol=4g。
