(11分)已知N2O4 (g) 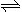 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
(1)现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”、“不变”或“减小” )。反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动。
(2分)(1)a、d
(4分)(2)不变 0.1mol·L-1·s-1
(5分)(3)NH4++H2O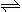 NH3·H2O+H+ 逆向
NH3·H2O+H+ 逆向
题目分析:(1)化学反应平衡的判断可从以下几方面考虑:体系中所有反应物和生成物的质量(或浓度)保持不变,正反应速率等于逆反应速率。对于N2O4 (g)  2NO2 (g),反应后体积变大,a密度不变,说明体积不变,故平衡;bΔH=E生-E反,ΔH不随时间的变化,但会随着化学计量数的变化而变化;c化学平衡应该是正逆反应速率相等,而图中表示的都是正反应速率;dN2O4的转化率不变,也说明了化学反应达到平衡。
2NO2 (g),反应后体积变大,a密度不变,说明体积不变,故平衡;bΔH=E生-E反,ΔH不随时间的变化,但会随着化学计量数的变化而变化;c化学平衡应该是正逆反应速率相等,而图中表示的都是正反应速率;dN2O4的转化率不变,也说明了化学反应达到平衡。
(2)化学平衡常数只是温度的函数,故温度不变,平衡常数就不变。
N2O4 (g) 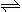 2NO2 (g)
2NO2 (g)
n前 1 0
n反 0.3 0.6
n后 0.7 0.6
V(N2O4)=0.3molL_1/3s=0.1molL_1/s
(3)NH4NO3是强酸弱碱盐,故水溶液铵根会水解,使溶液显酸性,方程式为NH4++H2O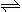 NH3·H2O+H+,氨水是弱碱,弱碱是抑制水的电离,故水的电离平衡将逆向进行。
NH3·H2O+H+,氨水是弱碱,弱碱是抑制水的电离,故水的电离平衡将逆向进行。
点评:此题考核了化学反应平衡的判断,也考核了化学平衡常数的知识和电离水解知识,要牢记盐类的水解促进水的电离,弱酸弱碱的电离抑制水的电离。
