多晶硅是太阳能光伏产业的重要原材料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s)=SiO(g)+CO(g) ΔH=a kJ·mol-1
2SiO(g)=Si(s)+SiO2(s) ΔH=b kJ·mol-1
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式为________________________________。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:
SiHCl3(g)+H2(g)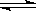 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。
不同温度及不同 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。
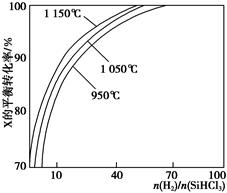
①X是________(填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1 150 ℃)________K(950 ℃)(填“>”、“<”或“=”)。
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
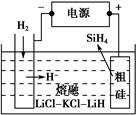
①用粗硅作原料,熔融盐电解法制取硅烷原理如图所示,电解时阳极的电极反应式为_________________________________________。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为________。
(1)①2a+b ②SiO+2NaOH=Na2SiO3+H2↑
(2)①SiHCl3 ②>
(3)①Si+4H+-4e-=SiH4↑ ②Si3N4
(1)①反应SiO2(s)+2C(s)=Si(s)+2CO(g)可由第一个反应×2+第二个反应得到,则ΔH=(2a+b)kJ·mol-1。②根据产物有硅酸钠及质量守恒得到反应的化学方程式为SiO+2NaOH=Na2SiO3+H2↑。(2)①根据图像,在温度不变的情况下,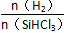 增大,X的平衡转化率增大,则X是SiHCl3。②当
增大,X的平衡转化率增大,则X是SiHCl3。②当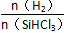 一定时,升高温度,SiHCl3的平衡转化率增大,则表明化学平衡常数K(1 150 ℃)>K(950 ℃)。(3)①电解时阳极发生氧化反应,粗硅失去电子,结合H-生成SiH4气体,则电极反应式为Si+4H--4e-=SiH4↑。②Si、N元素组成的化合物中Si的质量分数为60%,则
一定时,升高温度,SiHCl3的平衡转化率增大,则表明化学平衡常数K(1 150 ℃)>K(950 ℃)。(3)①电解时阳极发生氧化反应,粗硅失去电子,结合H-生成SiH4气体,则电极反应式为Si+4H--4e-=SiH4↑。②Si、N元素组成的化合物中Si的质量分数为60%,则 ,即化学式为Si3N4。
,即化学式为Si3N4。
