问题
问答题
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)______(B)______
(2)如果(A或B)不能,说明其原因______
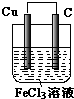
(3)如果(A或B)可以,则画出装装置图并写出正、负极的电极反应式
负极:______
正极:______.
答案
(1)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而(A)为非氧化还原反应,不能设计成原电池,(B)为氧化还原反应,可以设计成原电池,
故答案为:(A)不能(B)可以;
(2)原电池是将化学能转变为电能的装置,正极发生还原反应,负极发生氧化反应,A)为非氧化还原反应,没有发生电子的转移,故不能设计成原电池,
故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)在2FeCl3+Cu=2FeCl2+CuCl2反应中,FeCl3被还原,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+
Cu被氧化,为原电池负极反应,电极反应为 Cu-2e-=Cu2+,选取参加还原反应的电解质溶液为原电池的电解质溶液.
故答案为:Cu-2e-=Cu2+,2Fe3++2e-=2Fe2+,该装置图为