向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g) +2B(s) y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g); △H <0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
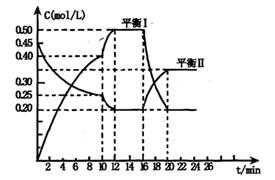
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填“变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 ;第16min引起曲线变化的反应条件可能是____ ;
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
(10分)(1)0.02mol/(L·min)(2分) (2)1∶2(2分) (3)变大(1分)
(4)④⑥(2分) ④(1分) (5)> (2分)
题目分析:(1)v(A)=(0.45mol/L-0.25mol/L)÷10min=0.02mol/(L·min)。
(2)根据图像分析及物质反应的物质的量之比等于化学计量数之比得知,x:y=1:2。
(3)根据(2)得知,正反应方向是体积增大的,故压强变大。
(4)l0min后化学反应速率加快了直到到达化学平衡状态,反应条件可能为升温和加催化剂,故选④⑥。16min后是化学平衡逆向移动,结合正反应是放热反应,故反应条件可能是升温,故选④。
(5)化学平衡常数等于生成物的幂之积除以反应物的幂之积,经过计算得K1>K2。
点评:本题考查反应速率、平衡常数计算、平衡移动等,难度中等,考查学生对基础知识的掌握程度。
