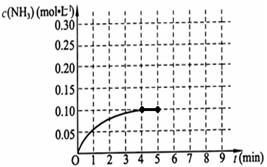
已知工业上合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
请回答下列问题:
(1) 写出该反应平衡常数的表达式K="_____"
(2)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(NH3) 为 ;
(3)5分钟时,保持其它条件不变,把容器的体积缩小一半,平衡 移动(填“向逆反应方向”、“向正反应方向”或“不”)。化学平衡常数将 (填“增大”、“减少”或“不变”)。
(4)N2和H2的反应还有其它应用。如:有人设想寻求合适的催化剂和电极材料,分别以N2、H2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式 。
(1) K=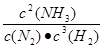 ;(2) 0.025mol.L-1.min-1
;(2) 0.025mol.L-1.min-1
(3) 正反应方向 不变 (4)N2+6e-+8H+=2NH4+
题目分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该反应的平衡常数表达式K=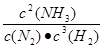 。
。
(2)根据图像可知,在反应进行到4分钟时,生成氨气的物质的量浓度是0.10mol/L,则用氨气表示的反应速率是0.10mol/L÷4min=0.025mol.L-1.min-1。
(3)5分钟时,保持其它条件不变,把容器的体积缩小一半,则压强增大,平衡向正反应方向移动。平衡常数只与温度有关系,所以该反应的平衡常数不变。
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。所以氢气在负极通入,氮气在正极通入,则正极电极反应式是N2+6e-+8H+=2NH4+。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。
