如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫。
在催化剂作用下,CO2和H2可以制取甲醇和乙醇。如:2CO2(g)+6H2(g) 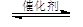 CH3CH2OH(g)+3H2O(g) 。
CH3CH2OH(g)+3H2O(g) 。
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表。分析表中数据回答下列问题:
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到800K D.使用合适的催化剂
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;
氢气的平衡浓度为 mol/L。
减小 , 不变 ; AB; 0.075 mol/(L.min); 1.75
题目分析:(Ⅰ)根据表中数据可知,随着温度的升高,CO2的转化率减小,这说明升高温度平衡向逆反应方向移动,则正反应是放热反应,由此升高温度平衡常数减小。平衡常数只与温度有关系,由此提高氢碳比[n(H2)/n(CO2)], 平衡常数K值不变。根据方程式可知,正反应是体积减小的可逆反应,则缩小容器的体积,增大压强,平衡向正反应方向进行;通入CO2,增大反应物的浓度,平衡向正反应方向进行;升高温度,平衡向逆反应方向进行,催化剂不能改变平衡状态,所以答案选AB。
(Ⅱ)根据图像可知,反应进行到10min时物质的浓度不再发生变化,说明反应达到平衡状态。此时生成甲醇的浓度是0.75mol/L,则从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=0.75mol/L÷10min=0.075 mol/(L·min)。根据方程式CO2(g)+3H2(g)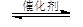 CH3OH(g)+H2O(g)可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,则剩余氢气的浓度是4mol/L-2.25mol/L=1.75mol/L。
CH3OH(g)+H2O(g)可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,则剩余氢气的浓度是4mol/L-2.25mol/L=1.75mol/L。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。
