以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体
(Na2Cr2O7·2H2O)的主要工艺流程如下
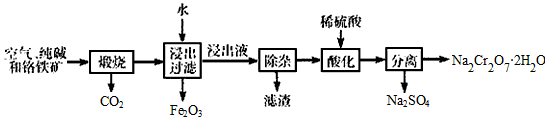
(1)煅烧过程中,铬铁矿中的Al2O3与纯碱反应的化学方程式为___________________
(2)酸化时发生的反应为2CrO42-+2H+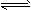 Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6 g,CrO42-有10/11转化为Cr2O72-。
Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6 g,CrO42-有10/11转化为Cr2O72-。
①酸化后所得溶液中c(Cr2O72-)=_____________
②已知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH=_______
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放。含
CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的
Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于_______mol/L,后续废水处理方能达到国家排放标准。
②还原法:CrO42-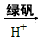 Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.5×10-3
mol/L的废水,至少需要绿矾(FeSO4·7H2O)____kg。
(1)Al2O3+Na2CO3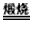 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2)①0.25 mol/L;②6
(3)2.4×10-4;12.51
