问题
选择题
已知反应:2SO2(g)+O2(g) 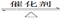 2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
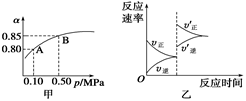
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
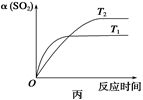
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
答案
答案:C
题目分析:A、图甲A点SO2的转化率为0.80,则SO2的平衡浓度为:2mol/10L(1-0.80)=0.04mol•L‾1,错误;B、图甲B点SO2的转化率为0.85,转化浓度为:0.2mol/L×0.85=0.17mol•L‾1,,则
2SO2(g)+O2(g) 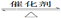 2SO3(g);
2SO3(g);
起始浓度(mol•L‾1) 0.2 0.1 0
转化浓度(mol•L‾1) 0.17 0.085 0.17
平衡浓度(mol•L‾1) 0.03 0.015 0.17
SO2、O2、SO3的平衡浓度之比为:6:3:34,错误;C、缩小容器容积,压强增大,平衡向右移动,正确;D、丙图中T1反应速率大,故T1>T2,错误。
