Ⅰ.将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的_______极,发生的电极反应为_______________。
(2)该电池工作时(放电)反应的总化学方程式为___________________________________。
Ⅱ.铅蓄电池是化学电源,它工作时的电池反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O;
试回答:
(3)铅蓄电池正极的电极材料是_____________。
(4)工作时该铅蓄电池负极的电极反应是_____________________。
(5)铅蓄电池工作时,电解质溶液的密度_______(填“减小”“增大”或“不变”,下同),pH_______。
(6)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,当制得0.05molCl2时,在理论上电池内部消耗的H2SO4的物质的量是______________。
I (1)负(1分);CH4+10OH--8e-=CO32-+7H2O(2分);
(2) CH4+2O2+2OH-=CO32-+3H2O(2分);
(3)PbO2(1分);
(4)Pb+SO42--2e-═PbSO4(2分);
(5)减小(1分);增大(1分);
(6)0.1mol(1分)。
题目分析:I (1)燃料燃烧时失电子发生氧化反应,原电池的负极上失电子发生氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
(2)甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH-=CO32-+3H2O。
II.(3)该反应中,PbO2得电子发生还原反应,发生还原反应的电极是正极,所以PbO2是正极PbO2;
(4)放电时,负极上失电子发生氧化反应,根据电池反应式知,铅失电子发生氧化会反应,所以负极上电极反应式为:Pb+SO42--2e-═PbSO4;
(5)根据电池反应式知,硫酸参加反应,且反应中生成水,导致溶质的量减少,溶剂的量增大,所以溶液的密度较小,溶液中氢离子浓度减小,则溶液的pH增大,故答案为:减小;增大;
(6)当制得0.05mol Cl2时,转移电子的物质的量=0.05mol×2=0.1mol,根据PbO2+Pb+2H2SO4 ═2PbSO4+2H2O知,当转移电子的物质的量为0.1mol时,消耗硫酸的物质的量=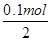 ×2=0.1mol。
×2=0.1mol。
