碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。
一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1℃时,测得各物质平衡时物质的量如下表:
| 活性炭 (mol) | NO (mol) | A (mol) | B (mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)在T1℃时,达到平衡共耗时2分钟,则NO的平均反应速率为 mol/(L·min);当活性炭消耗0.015mol时,反应的时间 (填“大于”、“小于”或“等于”)1分钟。
(2)在T1℃下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大活性炭的量 b.增大压强 c.升高温度 d.移去部分B
(3)结合上表数据,该反应的平衡常数表达式为 。(生成物A、B用相应的化学式表示)若T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,且K1>K2,能否判断该反应是吸热反应还是放热反应,说明理 。
(1)0.015mol/(L·min),小于(3分)
(2)a b(2分)
(3)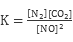 (1分) 不能,无法确定T1、T2的相对高低。(或能,当T1>T2时,反应是吸热反应,当T1<T2时,反应是放热反应(2分)
(1分) 不能,无法确定T1、T2的相对高低。(或能,当T1>T2时,反应是吸热反应,当T1<T2时,反应是放热反应(2分)
题目分析:
(1)该反应为: C + 2NO = CO2 + N2
起始量 2.030 0.100 0 0
平衡量 2.000 0.040 0.030 0.030
NO速率为 =0.015mol/(L·min),反应的速率随着浓度的减小而减小,故开始快,时间小于1min;
=0.015mol/(L·min),反应的速率随着浓度的减小而减小,故开始快,时间小于1min;
(2)a、C为固体,改变其量,不使化学平衡移动,b、增大压强平衡朝体积减小的方向移动,即正向,转化率增大;c、改变温度,平衡移动,转化率改变;d、减小生成物浓度,平衡正向移动,可以改变转化率。
(3)根据K变化,分析平衡移动方向,根据温度的变化可以评判的吸热还是放热。
