一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)= 。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。由此规律推出反应在6min时反应物的浓度a为 mol·L-1。
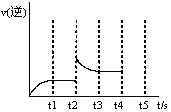
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是 、 (填写两顶)
(4)下列哪些情况表明容器中已达平衡状态 (填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
(10分)
(1)0.26mol·L-1·min-1(2分)
(2)每间隔2min,X的浓度为原来的一半(2分);0.075(2分)
(3)加入Z 增大体系的压强(2分)
(4)ACD(2分)
题目分析:
3min是△c(X)=0.39mol·L-1,v(X)=0.39mol·L-1/3min=0.13mol·L-1·min-1,而2v(X)="v(Z)=" 0.26mol·L-1·min-1。
根据题中数据,可见每间隔2min,X的浓度为原来的一半;由此规律推出反应在6min时反应物的浓度a为0.075 mol·L-1
t2时刻,v逆增大,可能的因素为加入生成物Z或增大体系的压强。
A、生成物Y是固体,未建立平衡时气体总质量在变化,密度也在变化,达平衡是不再变化,故可以说明,正确;B、平衡常数只与温度有关,错误;C、左右两边气体分子质量不同,只有平衡时气体的平均相对分子质量不随时间而变化,正确;D、Y的量不在变化,达到平衡,正确;E、2倍的Z的生成速率等于X的消耗速率才是平衡态,错误。
