已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。
(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g) 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
| 物 质 | M | N | P | Q |
| 起始投料/mol | 2 | 1 | 2 | 0 |
(本题共8分)(1)0.022 mol·L-1 0.09mol 大于 (3分) (2)c (2分)
(3)2.5 (1分) (4)该反应的平衡常数随温度的升高而减小(2分)
题目分析:(1)6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,则△c(A)=0.003mol•L-1•s-1×6s=0.018mol•L-1,故6s时A的浓度为0.2mol÷5L-0.018mol/L=0.022mol/L。△n(A)=0.018mol•L-1×5L=0.09mol,由方程式可知△n(C)=△n(A)=0.09mol
利用三段式计算平衡时各组分的物质的量,即
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
起始量(mol) 0.2 0.8 0 0
转化量(mol) 0.09 0.09 0.09 0.09
6s时(mol) 0.11 0.71 0.09 0.09
由于反应前后体积不变,所以浓度商Qc=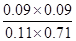 <1
<1
所以反应向正反应进行,故正反应速率大于逆反应速率
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误;b.该反应前后气体的体积不变,混合气体的质量不变,气体的密度始终不变,故b错误;c.可逆反应到达平衡时,各物质的浓度不变,故c(A)不随时间改变,说明到达平衡,故c正确;d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成,不能说明到达平衡,故d错误,答案选c。
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数,故1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为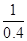 =2.5。
=2.5。
(4)由起始Q的物质的量为0可知,反应向正反应进行建立平衡,正反应是气体体积减小的反应,容器的体积不变,平衡时压强增大,故绝热条件下,混合气体的温度升高,即正反应为放热反应,升高温度平衡向逆反应进行,化学平衡常数减小,即该反应的平衡常数与温度的变化关系该反应的平衡常数随温度的升高而减小。
