(14分)(1)在固定容积为2L的密闭容器中通入NO和CO各2mol发生反应:

 随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
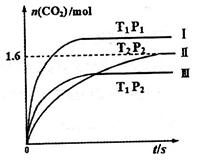
①曲线I、II、III对应反应从开始到平衡时用CO2表示的平均反应速率分别为 、
、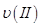 、
、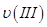 ,则三者大小关系为______________。
,则三者大小关系为______________。
②该反应△H__________0(填“>”、“=”或“<”);曲线II对应平衡常数K=_________;曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,则再达平衡时NO的转化率将_______(填“增大”、“减小”或“不变”)。
(2)①25℃时,将0.2mol/L的HCOOH溶液与0.2mol/L的NaOH 溶液等体积混合,充分反应后测得溶液pH为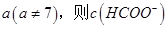 ________
________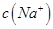 (填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
(填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
②一定温度下,0.2mol/Lr HCOOH溶液加水稀释过程中,下列各项中随着加水量的增加而减小的是____________(填写字母序号)。
a.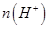 b.
b.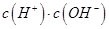 c.
c.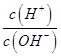 d.
d.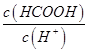
(1)① υ(Ⅰ)>υ(Ⅲ)>υ(Ⅱ); ② <,160,增大
(2)① <,1.0×102a-27; ② c、d(错答扣分)
题目分析:(1)①根据图像的斜率可以比较出速率的大小;
②对比Ⅱ、Ⅲ两条曲线,温度升高,CO2的物质的量减小,平衡向左移动,该反应为放热反应;曲线Ⅱ平衡后,n(CO2)=1.6mol,根据化学方程式可以求出各物质的平衡浓度,进而求出平衡常数;再通入2molNO和2molCO并保持温度不变,压强增大,NO的转化率增大。
(2)①HCOONa为弱酸强碱盐,HCOO‾水解,浓度减小;等体积混合,溶液体积变为原来的2倍,C(HCOO‾)=0.1mol•L‾1,C(CH3COOH)=C(OH‾)=Kw/C(H+)=1.0×10a-14mol•L‾1,带入Kh= C(CH3COOH) C(OH‾)/ C(HCOO‾),可得水解常数。
②加水后,C(H+)减小,C(OH‾)增大,而电离平衡向右移动,所以c、d正确。
