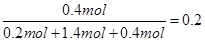已知A(g)+B(g) 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1) 该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2) 容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变 b. c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变 d. 压强不随时间改变
(3)1200℃时反应2C(g)  A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
(4)830℃时,向一个10.00 L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)= ____mol·L-1·s-1; 2s时c(B)= ____ mol·L-1; 2s时A的转化率为____;2s时C的体积分数为____。
(1) 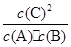 (1分) < (1分)
(1分) < (1分)
(2)b(1分)
(3)2. 50(1分)
(4) 0.010 (1分) 0.14 (1分) 0.50 (1分) 20%(1分)
题目分析:(1)温度越高,平衡常数越小,表明升高温度,平衡逆向移动,正向是放热反应。
(2) 容积固定,该反应中反应物和生成物都是气体,质量一定,所以无论平衡与否,该容器内的气体密度都不会随时间改变。反应前后气体的分子数为变,质量一定,因些混合气体的平均相对分子质量不管平衡与否都不随时间改变。分子数在反应前后 不变,因此压强始终不变。
(3)该平衡的平衡常数为题中1200度时的平衡常数的倒数。
(4)依题意可知v(C)= 0.02mol·L-1·s-1;所以v(A)= 0.01mol·L-1·s-1;
A(g) + B(g)  2 C(g)
2 C(g)
起始: 0.40mol 1.60mol 0
转化: 0.20mol 0.20mol 0.40mol
平衡: 0.20mol 1.40mol 0.40mol
C的体积分数也就是C的物质的量分数,为: